周一(6月7日),美國食品藥物監督管理局(FDA)公佈決定,批准百健公司(Biogen Inc.)研發的新藥Aduhelm為解決阿茲海默症(Alzheimer)根本病因的首選藥物。這是FDA近20年來批准的首個治療該病的新藥,可以減緩患者認知能力衰退。
FDA周一批准的新藥,藥物分子名稱為Aducanumab,將以Aduhelm的名稱出售,該藥物被譽為阿茲海默症藥物研究的一個分水嶺。百健公司投資了數十億美元,開發了這種療法達到了以前批准的阿茲海默症藥物不能達到的效果,即減緩患者的記憶衰退進程。
百健公司行政總裁沃納索斯(Michel Vounatsos)發表聲明稱:「這一歷史性時刻是阿茲海默症複雜領域十多年來突破性研究的結晶。我們準備將這種新藥帶給患者,並開始解決這一日益嚴重的全球健康危機。」
他還表示,相信這一流藥物將改變患者治療方式,在未來幾年激發持續創新。
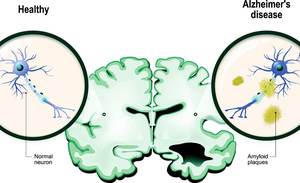
Aduhelm的藥理為清除阿茲海默症早期患者大腦中的β澱粉樣蛋白沉積物,避免其對大腦造成可「喪失記憶和自理能力的」破壞。
FDA認同這一治療理論,稱Aduhelm可以有效減少β澱粉樣蛋白的沉積斑塊,延緩和改善患者大腦的衰退速度。但百健臨床試驗數據高度複雜,存在不確定性。
本次批准Aduhelm屬於加速審批(Accelerated Approval),FDA要求百健公司仍須在審批後繼續臨床試驗,以驗證該藥的臨床效果。儘管該過程可能需要數年時間,但在此期間FDA允許百健公司銷售該藥。如果該研究未能證明其有效性,FDA可能會將該藥物撤出市場。
儘管Aduhelm獲得批准是意料中事,但也具有爭議性,因為FDA去年11月召集的獨立專家小組認為,並無足夠證據證明這種藥物的療效,因此建議不予批准。
這種藥物曾進行第3期人體試驗,其中一項試驗產生了減少認知能力退化的結果,但另一項試驗無此結果。
在獲得審批後,百健公司股價立刻跳漲近52%,至434.52美元。百健表示,Aduhelm的定價為每年5.6萬美元,預計美國約有150萬人有資格接受這種藥物治療,但由於患者需要每月接受一次輸液,也引發外界關注該藥對醫療系統成本的影響。
阿茲海默症是美國第六大死亡原因,根據保險公司Cigna的估計,美國約有600萬人患有阿茲海默症。根據美國疾病控制與預防中心(CDC)的數據,2019年美國有121,499人死於阿茲海默症,比10年前增加了54%。考慮到年齡和人口增長,同期人均死亡人數增長了23%。
加拿大皇家銀行資本市場分析師亞伯拉罕(Brian Abrahams)在6月1日給客戶的一份報告中表示,FDA的決定預計將在整個生物製藥行業引起反響。
瑞士製藥公司「諾華公司」(Novartis)行政總裁納拉辛漢(Vas Narasimhan)周一在接受CNBC採訪時表示:「這反映出FDA正在尋找方法,推動治療方式的發展,這些患者群體的巨大需求尚未得到滿足,這無疑為他們打開了大門。」◇
-------------------
局勢持續演變
與您見證世界格局重塑
-------------------
🔔下載大紀元App 接收即時新聞通知:
🍎iOS:https://bit.ly/epochhkios
🤖Android:https://bit.ly/epochhkand
📰周末版實體報銷售點👇🏻
http://epochtimeshk.org/stores