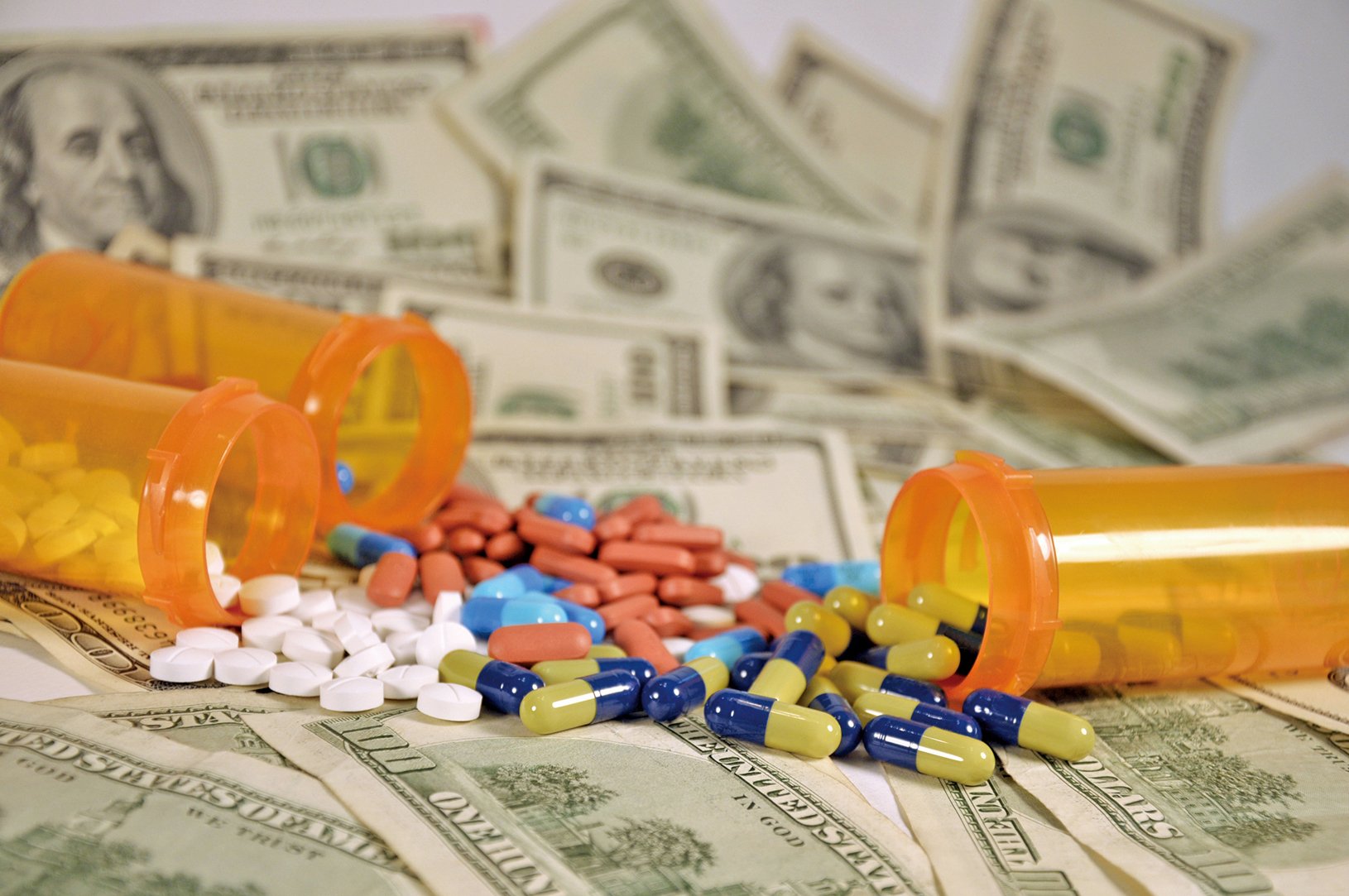
最近幾周,中國爆發假疫苗、降壓藥含致癌物等藥品安全醜聞。由於中國是全球最大的活性藥物成份供應商,醜聞引發國際消費者對全球供應鏈健康風險的擔憂。
《金融時報》8月6日報道,因中國藥物質量問題頻發,美國食品和藥物管理局(FDA)向中國醫藥製造商發出的警告信函數量已經從2014年的5個,上升到去年的22個。這是中國藥物被美國列入進口黑名單的前兆。
英國藥品監管機構表示,中國製造商生產的活性藥物成份產量佔全球的40%。今年7月第一宗藥物醜聞幕後推手就是一家中國API(原料藥生產商)。
今年7月,歐洲藥品管理局(EMA)和美國食品和藥物管理局(FDA)發佈警報,指稱浙江華海提供的降血壓藥物中含有致癌成份,導致全球22個國家發起召回受影響藥物的行動。
接下來,在中國爆發數十萬種不合格疫苗的醜聞,引起中國人強烈抗議。涉案的長生生物科技公司還被當局指控在瘋狗症疫苗生產過程中偽造數據。
中國API不嚴格遵循流程
這兩個案例都表明,儘管中共政府在2008年三聚氰胺嬰兒奶粉污染危機後採取行動,但中國仍面臨製造業質量問題。
此外,這些問題是在中共於2018年4月宣佈新的質量標準和製藥稅收激勵措施之後發生的。
數據顯示,中國擁有超過5,000家API製造商,其中約500家是出口商。去年出口額達290億美元。
這些生產商為Teva Pharmaceutical等仿製藥製造商,以及強生和諾華等跨國公司供應原料。根據行業估計,美國大約80%的API來自中國和印度。
「許多(中國)API公司並沒有嚴格遵循既定的(製造)流程,也沒有嚴格記錄數據。」安永在中國合夥公司的林約翰(John Lin)說。
FDA和EMA警告中國API
進口中國原料藥的公司自己進行檢測,並向FDA和EMA等監管機構報告違規行為,這些監管機構也可以檢查中國生產商,並實施進口禁令。
行業人士表示,中國製造商十分擔心這些FDA的警告信件,FDA北京辦事處主任貝克(Peter Baker)被中國製造商稱為「殺手」(Killer)。今年到目前為止,FDA已經向中國製造商發出了11封警告信,而EMA已經發出了6封投訴。
根據EMA的數據,歐盟國家當局每年對中國API製造商進行20-40次檢查,其中約10%的檢查發現不合規。
專注於醫療保健監管的行業機構Raps在2016年報告中說:「關於FDA如何充份跟蹤藥物和API供應鏈的問題開始讓國會感到擔憂。」
印度公司也經常收到警告,但過去兩年中國公司收到的警告比印度公司多。
近年來FDA和EMA對中國公司發佈的警告表明,有數十家公司違反了標準,主要涉及製造過程中的紀錄保存。在一些情況下,出口商在被發現違規行為之前已經運送了大量產品。
例如,在去年發給中國常州金壇千藥製藥原料的警告中,FDA表示,該公司在2016年之前沒有任何與質量相關的程序,而它正在向美國運送藥品。公司工作人員告訴FDA檢查員,他們缺乏書面紀錄,因為「倉庫員工負責處理原材料處理、取樣和測試」。
中國是假冒和缺陷藥來源
醫療保健智囊團黑斯廷斯中心(Hastings Center)的顧問吉布森(Rosemary Gibson)表示,製藥業削減成本是降低標準的真正罪魁禍首。「全球化事實上是放鬆管制。」她補充說。
耶魯大學公共衛生學院教授陳曦表示,最近的醜聞「可能是中國醫藥行業的一大挫折」。批評人士說,中共地方官員仍然保護小生產者,而檢查員的低工資使他們容易受到賄賂。
「現在對中國製造的藥品缺乏信任,」吉布森在7月對英文《大紀元》說。
她說:「公眾希望他們的藥物安全。這種隱藏在纈沙坦(華海公司生產的藥物)中的致癌物引發了一個問題,即中國生產的其它產品是否與我們接受的全球標準相悖。」
美中經濟與安全審查委員會在2018年1月發佈的年度報告中說,中國是有缺陷和假冒藥品的「多產地」。
「由於對國內藥品質量的擔憂,中國消費者可能更喜歡美國藥品。中國一直是假冒和缺陷藥物的多產來源。2012年,中共當局查獲了7,700萬個國產凝膠膠囊,這些凝膠膠囊是由工業廢物製成的,含有過量的鎘。」該委員會的報告指出。◇
------------------
📰支持大紀元,購買日報:
https://www.epochtimeshk.org/stores
📊InfoG:
https://bit.ly/EpochTimesHK_InfoG
✒️名家專欄:
https://bit.ly/EpochTimesHK_Column